Плавление
Плавление
Нет такого твердого тела, которое сколько угодно противостояло бы повышению температуры. Рано или поздно твердый кусочек превращается в жидкость; правда, в некоторых случаях нам не удастся добраться до температуры плавления – может произойти химическое разложение.
По мере возрастания температуры молекулы движутся все интенсивнее. Наконец, наступает такой момент, когда поддержание порядка среди сильно «раскачавшихся» молекул становится невозможным. Твердое тело плавится. Самой высокой температурой плавления обладает вольфрам: 3380 °C. Золото плавится при 1063 °C, железо – при 1539 °C. Впрочем, есть и легкоплавкие металлы. Ртуть, как хорошо известно, плавится уже при температуре ?39 °C. Органические вещества не имеют высоких температур плавления. Нафталин плавится при 80 °C, толуол – при ?94,5 °C.
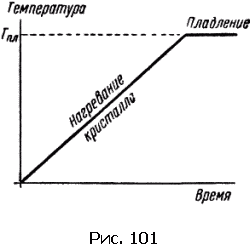
Измерить температуру плавления тела, в особенности если оно плавится в интервале температур, который измеряют обычным термометром, совсем нетрудно. Совсем не обязательно следить глазами за плавящимся телом. Достаточно смотреть на ртутный столбик термометра (рис. 101). Пока плавление не началось, температура тела растет. Как только плавление начинается, повышение температуры прекращается, и температура останется неизменной, пока процесс плавления не закончится полностью.
Как и превращение жидкости в пар, превращение твердого тела в жидкость требует тепла. Необходимая для этого теплота называется скрытой теплотой плавления. Например, плавление одного килограмма льда требует 80 больших калорий.
Лед относится к числу тел, обладающих большой теплотой плавления. Плавление льда требует, например, в 10 раз больше энергии, чем плавление такой же массы свинца. Разумеется, речь идет о самом плавлении, мы здесь не говорим, что до начала плавления свинца его надо нагреть до +327 °C. Из-за большой теплоты плавления льда замедляется таяние снега. Представьте себе, что теплота плавления была бы в 10 раз меньше. Тогда весенние паводки приводили бы ежегодно к невообразимым бедствиям.
Итак, теплота плавления льда велика, но она же и мала, если ее сравнить с теплотой парообразования в 540 больших калорий на килограмм (в семь раз меньше). Впрочем, это различие совершенно естественно. Переводя жидкость в пар, мы должны оторвать молекулы одну от другой, а при плавлении нам приходится лишь разрушить порядок в расположении молекул, оставив их почти на тех же расстояниях. Ясно, что во втором случае требуется меньше работы.
Наличие определенной точки плавления есть важный признак кристаллических веществ. Именно по этому признаку их легко отличить от других твердых тел, называемых аморфными или стеклами. Стекла встречаются как среди неорганических, так и среди органических веществ. Оконные стекла делаются обычно из силикатов натрия и кальция; на письменный стол кладут часто органическое стекло (его называют еще плексиглас). Аморфные вещества в противоположность кристаллам не имеют определенной температуры плавления. Стекло не плавится, а размягчается. При нагревании кусок стекла сначала становится из твердого мягким, его легко можно гнуть или растягивать; при более высокой температуре кусок начинает изменять свою форму под действием собственной тяжести. По мере нагревания густая вязкая масса стекла принимает форму того сосуда, в котором оно лежит. Эта масса сначала густа, как мед, потом – как сметана и, наконец, становится почти такой же маловязкой жидкостью, как вода. При всем желании мы не можем здесь указать определенной температуры перехода твердого тела в жидкое. Причины этого лежат в коренном отличии строения стекла от строения кристаллических тел. Как говорилось выше, атомы в аморфных телах расположены беспорядочно. Стекла по строению напоминают жидкости. Уже в твердом стекле молекулы расположены беспорядочно. Значит, повышение температуры стекла лишь увеличивает размах колебаний его молекул, дает им постепенно все большую и большую свободу перемещения. Поэтому стекло размягчается постепенно и не обнаруживает резкого перехода «твердое» – «жидкое», характерного для перехода от расположения молекул в строгом порядке к беспорядочному расположению.
Когда речь шла о кривой кипения, мы рассказали, что жидкость и пар могут, хотя и в неустойчивом состоянии, жить в чужих областях – пар можно переохладить и перевести влево от кривой кипения, жидкость – перегреть и оттянуть вправо от этой кривой.
Возможны ли аналогичные явления в отношении кристалла с жидкостью? Оказывается, аналогия тут неполная.
Если нагреть кристалл, то он начнет плавиться при своей температуре плавления. Перегреть кристалл не удастся. Напротив, охлаждая жидкость, можно, если принять некоторые меры, сравнительно легко «проскочить» температуру плавления. В некоторых жидкостях удается достигнуть больших переохлаждений. Есть даже такие жидкости, которые легко переохладить, а трудно заставить кристаллизоваться. По мере охлаждения такой жидкости она становится все более вязкой и наконец затвердевает, не кристаллизуясь. Таково стекло.
Можно переохладить и воду. Капельки тумана могут не замерзать даже при сильных морозах. Если в переохлажденную жидкость бросить кристаллик вещества – затравку, то немедленно начнется кристаллизация.
Наконец, во многих случаях задержавшаяся кристаллизация может начаться от встряски или от других случайных событий. Известно, например, что кристаллический глицерин был впервые получен при транспортировке по железной дороге. Стекла после долгого стояния могут начать кристаллизоваться (расстекловываться, или «зарухать», как говорят в технике).
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК