4.11. Как правильно есть морской лед
Живущие у моря жители Севера знают, что свежий, только что замерзший лед есть или растапливать нельзя: он слишком соленый. Но старый, многолетний лед для этих целей подходит. Они также знают, что можно улучшить вкус льда, если недавно замерзшую льдину вытащить на берег, желательно весной или летом, когда тепло. Почему лед становится менее соленым при теплой погоде, когда испарение уменьшает количество воды в льдине, концентрация соли увеличивается и, казалось бы, лед должен был бы стать более соленым?
ОТВЕТ • Когда морская вода замерзает, соль (и другие примеси) не встраиваются в структуру кристалла льда, а образуют вкрапления, которые называют ячейками рассола. Ячейки рассола медленно мигрируют в слое льда, перемещаясь вниз, и поэтому соляной раствор постепенно выходит из льдины. Если температура льда повышается, например когда льдину вытаскивают и оставляют лежать на берегу на солнце, ячейки рассола перемещаются быстрее и скорость опреснения увеличивается.
На рис. 4.2 показана ячейка рассола в слое льда. Температура льда сверху совпадает с температурой воздуха, равной –5°C; температура льда снизу равняется 0°C, то есть температуре замерзания воды, а соленая вода внутри ячейки раствора имеет температуру –2°C. Вода внутри ячейки не замерзает, поскольку соль понижает ее точку замерзания — молекулы соли влияют на способность молекул воды образовывать кристаллическую ледяную структуру. Лед в низу ячейки постепенно тает, поскольку тепло передается с низа ледяного слоя вверх. Вода в верху ячейки постепенно замерзает, поскольку тепло поднимается к поверхности слоя льда. Таким образом сама ячейка перемещается вниз. Достигнув нижней поверхности льдины, она отдает соль воде подо льдом или почве. Так постепенно лед опресняется.
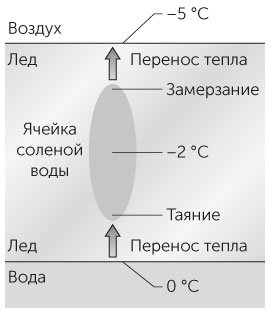
Рис. 4.2 / Задача 4.11. Ячейка рассола, двигающаяся вниз через слой льда к воде.
С теплообменом между льдом и водой связан следующий удивительный результат: если кубик льда (из пресной воды), температура которого равна –1°C, поместить в очень соленую воду той же температуры, он растет, хотя температуры льда и воды равны. Чтобы объяснить, как это получается, предположим, что соль понижает точку замерзания воды до –2°C. На границе раздела между двумя состояниями воды наблюдается повышенная активность на молекулярном уровне: молекулы воды непрерывно переходят туда-сюда из льда в жидкую воду и обратно. Однако, если число молекул, ушедших из льда, равно числу молекул, перешедших в лед из воды, количество льда не меняется. В воде происходит электролитическая диссоциация молекул соли, и молекулы воды собираются вокруг получившихся ионов наподобие детей, толпящихся вокруг ларька с мороженым — этот процесс называется гидратацией. Теперь процессу перехода молекул из воды в лед мешают молекулы соли, связывающие молекулы воды. Таким образом, молекулы воды покидают кубик льда, но другие молекулы туда не поступают, и, следовательно, кубик растворяется.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК