Атомные превращения
Открытие в 1898 году нескольких новых элементов в радиоактивной руде вызвало некоторые затруднения. В периодической таблице было место лишь для 9 радиоактивных элементов (атомные числа от 84 до 92). То есть для радия, полония и некоторых других элементов место было, но что делать с остальными? Ведь если брать только дочерние элементы урана и тория с четко выраженными свойствами и определенной интенсивностью излучения, у физиков будет несколько десятков новых элементов.
Каждому типу излучения было дано свое название. Например, уран Xp, уран Xy, радий А, радий В и так далее вплоть до радия G. Были также излучения тория от А до D, два мезотория, один радиоторий и т. д. Но если элементов действительно столько же, сколько и различных излучений, как же их вписать в таблицу? С открытием Мозли атомного числа задача еще более усложнилась.
Для начала давайте рассмотрим природу этих радиоактивных излучений и их влияние на испускающий их атом. (Я прибегну к протонно-нейтронной модели атомного ядра, несмотря на то что изначально описываемый мною анализ был сделан на основе протонно-электронной модели.)
Возьмем произвольный элемент Q, ядро которого состоит из?протонов и у нейтронов. Значит, его атомное число равняется x, а его атомный вес x + y. Запишем атомное число текстом нижнего регистра перед символом элемента, а атомный вес — текстом верхнего регистра после символа. Получаем xQx+y.
Теперь предположим, что атом этого элемента испустил одну альфа-частицу (обозначается греческой ?). Альфа-частица состоит из двух протонов и двух нейтронов, следовательно, ее атомное число 2, а атомный вес 4. В записи это выглядит как 2?4.
То, что остается от исходного атома после выхода альфа-частицы, должно содержать x–2 протона и y–2 электрона. Атомное число уменьшается на 2 (и образуется новый элемент R), атомный вес — на 4. Это можно записать так:
xQx+y? x–2Rx+y–4+ 2?4 (Уравнение 8.1)
Если же исходный атом испустил бета-частицу (обозначается греческой ?), ситуация будет несколько иной. Выход бета-частицы означает, что внутри ядра один нейтрон превратился в протон. Значит, теперь количество протонов в ядре будет x+1, а нейтронов у–1. Атомное число увеличится на 1, а атомный вес останется прежним, т. к. x + 1 + y – 1 = x + y.
Атомный вес самой бета-частицы практически равен 0. (Точнее, 0,00054, но в данном случае мы можем сократить его до 0.) Так как атомный вес равняется числу положительно заряженных частиц в ядре и так как бета-частица является электроном, а следовательно, обладает единичным отрицательным зарядом, ее атомное число равняется –1. Таким образом, бета-частицу можно обозначить как –1?0, а процесс выхода как
xQx+y ? x+1Rx+y + –1?0 (Уравнение 8.2)
Обратите внимание, что в уравнениях 8.1 и 8.2 сумма атомных чисел правой части равняется сумме атомных чисел левой части в соответствии с законом сохранения электрического заряда. То же можно сказать и об атомных весах правой части формулы 8.2 согласно закону сохранения массы. (Пока мы можем пренебречь небольшим изменением массы при ее переходе в энергию.)
Гамма-луч обозначается греческой буквой ?. Гамма-излучение является электромагнитным, следовательно, не имеет ни атомного веса, ни атомного числа. Запись будет выглядеть как 0?0. Добавляем следующую формулу:
xQx+y ? xQx+y + 0?0. (Уравнение 8.3)
Таким образом, когда атом испускает альфа-частицу, его атомное число уменьшается на 2, а атомный вес — на 4. Когда атом испускает бета-частицу, его атомное число уменьшается на 1, а атомный вес остается неизменным. Когда же атом испускает гамма-луч, его и атомное число, и атомный вес остаются неизменными. Этот закон впервые был сформулирован Содди в 1913 году.
Давайте применим этот закон к атому урана с атомным числом 92 и атомным весом 238, т. е. 92U238. Слабое радиоактивное излучение урана высокой очистки состоит из альфа-частиц. Испускание альфа-частицы уменьшает атомное число атома урана до 90, т. е. до атомного числа тория, а атомный вес до 234. Запись выглядит так:
92U238 ? 90Th234 + 2?4. (Уравнение 8.4)
Атом тория, полученный в результате распада атома урана, несколько отличается от атома тория, содержащегося в руде. Атомное число последнего также равняется 90, однако его атомный вес равен 232, то есть 90Th232.
Атомное число и одного и другого атома равно 90, поэтому они оба занимают одну и ту же ячейку периодической таблицы. Содди обнаружил это в 1913 году и предложил называть элементы, имеющие одинаковое атомное число и различающиеся атомным весом, изотопами (от греч., означает «одно и то же место», то есть одно и то же место в периодической таблице).
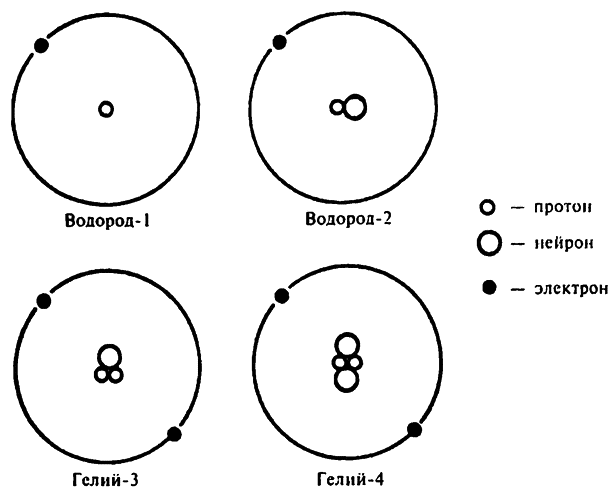
Так как атомное число изотопов одного и того же элемента одинаково, химики решили на письме отображать лишь их атомные веса: торий–234 и торий–232, или, более кратко, Th232 и Th234.
С точки зрения химии вполне обоснованно помещать изотопы в одну и ту же ячейку периодической таблицы. Торий–234 и торий–232 имеют в ядре по 90 протонов и соответственно по 90 электронов в нейтральном атоме. Химические свойства элементов определяются распределением электронов по электронным уровням, а значит, химические свойства этих двух изотопов тория, как и изотопов любых других элементов, будут одинаковыми[131].
Но, несмотря на то что у атомов изотопов на энергетических уровнях один и тот же набор электронов, они все же отличаются структурой атомных ядер. Количество протонов в ядре изотопов одинаково, значит, неодинаково количество нейтронов. Например, ядро атома тория–234 состоит из 90 протонов и 144 нейтронов, в то время как ядро атома тория–232 состоит из 90 протонов и 142 нейтронов.
Простые изотопы
Когда речь идет об изменениях внутри атомного ядра, например когда мы говорим о радиоактивности (в то время как во время химических преобразований изменяется лишь число электронов, атомное ядро остается неизменным), различия в количестве нейтронов в ядре очень важны.
Итак, процесс распада тория–232 идет очень медленно, именно поэтому этот элемент до сих пор присутствует в земной коре. Атом тория испускает альфа-частицу и его атомное число падает до 88, т. е. до радия. Запишем это:
90Th234 ? 91Pa234 + 2?4. (Уравнение 8.5)
С другой стороны, процесс распада атомов тория–234 идет крайне быстро, и именно поэтому в природе этот элемент встречается только в исчезающе малых количествах в урановой руде. Более того, при распаде тория–234 выделяется бета-частица, что приводит к увеличению атомного числа до 91, то есть до протактиния:
90Th234 ? 91Ра234 + –1?0. (Уравнение 8.6)
После выхода альфа- или бета-частицы может образоваться новый атом, заряд ядра которого будет выше, чем у атома основного состояния. После возврата в прежнее состояние атом испускает гамма-луч. В некоторых случаях это происходит не сразу, атом существует какое-то время, а радиационное излучение его возбужденного ядра обладает уникальными характеристиками. Для обозначения наличия возбужденного ядра символ элемента помечают звездочкой. В процессе образования протактиния–234 его ядро переходит в возбужденное состояние:
91Pa234* ? 91Pa234 + 0?0. (Уравнение 8.7)
В 1936 году Лизе Майтнер предложила называть атомы с одинаковыми атомными числами и атомными весами, но различающиеся структурой ядра, изомерами. Первый случай ядерной изомерии был зафиксирован на примере протактиния–234 еще в 1921 году Отто Ганом, давним партнером Майтнер по работе.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК